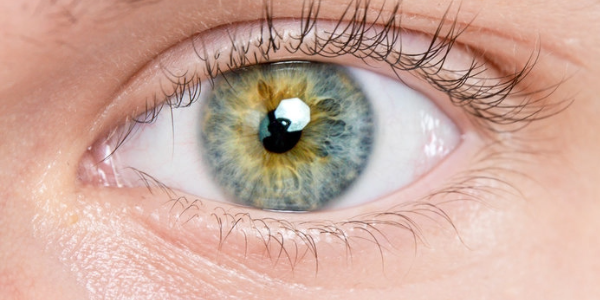
Das menschliche Auge ist komplex und irreparabel, doch strukturell ähnelt es dem der Süßwasser-Apfelschnecke, die ihre Augen vollständig regenerieren kann. Alice Accorsi, Assistenzprofessorin für Molekular- und Zellbiologie an der University of California in Davis, untersucht, wie diese Schnecken ihre Augen nachwachsen lassen – mit dem Ziel, irgendwann Menschen mit Augenverletzungen zu helfen, damit sie ihr Sehvermögen wiedererlangen. In einer neuen Studie, die in Nature Communications veröffentlicht wurde, zeigt Accorsi, dass Apfelschnecken und menschliche Augen viele anatomische und genetische Merkmale gemeinsam haben.
Apfelschnecken haben Augen wie eine Kamera und eine gute Regenerationsfähigkeit
„Apfelschnecken sind außergewöhnliche Organismen“, so Accorsi. „Sie bieten eine einzigartige Gelegenheit, die Regeneration komplexer Sinnesorgane zu untersuchen. Bislang fehlte uns ein System, um die vollständige Regeneration des Auges zu erforschen.“ Ihr Team entwickelte auch Methoden zur Bearbeitung des Genoms der Apfelschnecke, mit denen sie die genetischen und molekularen Mechanismen der Augenregeneration erforschen können.

Die Goldapfelschnecke (Pomacea canaliculata) ist eine Süßwasserschneckenart aus Südamerika. Sie ist mittlerweile an vielen Orten weltweit invasiv, aber laut Accorsi sind genau die Eigenschaften, die Apfelschnecken so invasiv machen, auch der Grund, warum sie sich so gut für Laborversuche eignen. Apfelschnecken sind widerstandsfähig, ihre Generationszeit ist sehr kurz und sie haben viele Nachkommen. Außerdem lassen sich Apfelschnecken leicht im Labor züchten und haben „kameraähnliche“ Augen – genau wie Menschen. Schnecken sind seit Jahrhunderten für ihre Regenerationsfähigkeit bekannt. Bereits 1766 stellte ein Forscher fest, dass geköpfte Gartenschnecken ihren gesamten Kopf nachwachsen lassen können. Accorsi ist jedoch die Erste, die diese Eigenschaft für die Regenerationsforschung nutzt.
Im Tierreich gibt es viele Arten von Augen, aber Kameraaugen sind dafür bekannt, dass sie besonders hochauflösende Bilder liefern. Sie bestehen aus einer schützenden Hornhaut, einer Linse zur Fokussierung des Lichts und einer Netzhaut, die Millionen von lichtempfindlichen Photorezeptorzellen enthält. Sie kommen bei allen Wirbeltieren, einigen Spinnen, Tintenfischen und Kraken sowie einigen Schnecken vor. Mithilfe einer Kombination aus Sezierungen, Mikroskopie und Genomanalysen konnte Accorsis Team zeigen, dass die Augen der Apfelschnecke anatomisch und genetisch den menschlichen Augen ähneln.
Wie man ein Auge nachwachsen lässt
Wie wachsen den Schnecken also nach der Amputation ihre Augen nach? Die Forscher zeigten, dass der Prozess etwa einen Monat dauert und mehrere Phasen umfasst. Zunächst muss die Wunde heilen, um Infektionen und Flüssigkeitsverlust zu verhindern, was in der Regel etwa 24 Stunden dauert. Dann wandern unspezialisierte Zellen in den Bereich und vermehren sich. Im Laufe von etwa anderthalb Wochen spezialisieren sich diese Zellen und beginnen, Augenstrukturen wie die Linse und die Netzhaut zu bilden. Am 15. Tag nach der Amputation sind alle Strukturen des Auges vorhanden, einschließlich des Sehnervs, aber diese Strukturen reifen noch mehrere Wochen lang weiter und wachsen. „Wir haben noch keine schlüssigen Beweise dafür, dass sie Bilder sehen können, aber anatomisch gesehen verfügen sie über alle Komponenten, die für die Bildung eines Bildes erforderlich sind“, so Accorsi. „Es wäre sehr interessant, einen Verhaltenstest zu entwickeln, um zu zeigen, dass die Schnecken mit ihren neuen Augen Reize genauso verarbeiten können wie mit ihren ursprünglichen Augen. Daran arbeiten wir derzeit.“
Das Team untersuchte auch, welche Gene während des Regenerationsprozesses aktiv waren. Sie zeigten, dass die Schnecken unmittelbar nach der Amputation etwa 9.000 Gene hatten, die im Vergleich zu normalen erwachsenen Schneckenaugen unterschiedlich stark exprimiert wurden. Nach 28 Tagen waren 1.175 Gene im regenerierten Auge immer noch unterschiedlich exprimiert, was darauf hindeutet, dass die Augen zwar nach einem Monat vollständig entwickelt aussehen, die vollständige Reifung jedoch länger dauern könnte.
Gene für die Regeneration
Um besser zu verstehen, wie Gene die Regeneration regulieren, entwickelte Accorsi Methoden zur Bearbeitung des Genoms der Schnecken mit CRISPR-Cas9. Als ersten Test mutierte das Team mit CRISPR/Cas9 ein Gen namens pax6 in Schneckenembryonen. Pax6 steuert bekanntermaßen die Entwicklung und Organisation von Gehirn und Augen bei Menschen, Mäusen und Fruchtfliegen. Wie Menschen haben auch Schnecken zwei Kopien jedes Gens – eine von jedem Elternteil. Die Forscher zeigten, dass Apfelschnecken mit zwei nicht funktionsfähigen Versionen von pax6 ohne Augen entwickeln, was belegt, dass pax6 auch für die anfängliche Augenentwicklung bei Apfelschnecken unerlässlich ist.
Accorsi arbeitet nun am nächsten Schritt: Sie will testen, ob pax6 auch eine Rolle bei der Regeneration der Augen spielt. Um dies zu bestimmen, müssen die Forscher pax6 bei erwachsenen Schnecken mutieren oder ausschalten und dann deren Regenerationsfähigkeit testen. Sie untersucht auch andere Augen-Gene, darunter Gene, die bestimmte Teile des Auges wie die Linse oder die Netzhaut kodieren, sowie Gene, die pax6 steuern.„Wenn wir eine Reihe von Genen finden, die für die Regeneration des Auges wichtig sind, und diese Gene auch in Wirbeltieren vorhanden sind, könnten wir sie theoretisch aktivieren, um die Regeneration des Auges beim Menschen zu ermöglichen“, so Accorsi.